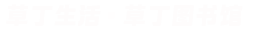铅蓄电池原理方程式
【铅蓄电池原理方程式】
充电时:
负极反应du:PbSO?+2e?=Pb+SO?2? 。
正极反应:PbSO?+2H?O=PbO?+2e-+4H++SO?2- 。
放电时:
负极反应:Pb-2e+SO?2-=PbSO? 。
正极反应:PbO?+2e?+4H++SO?2?=PbSO?+2H?O 。
铅酸电池的基本结构是将二氧化铅和金属铅制成的电极插入到稀硫酸溶液中 。它以海绵状的铅作为负极,二氧化铅作为正极,用硫酸水溶液作为电解液,它们共同参与电池的电化学反应 。当电路接通时,正极的二氧化铅得到电子变成硫酸铅,而负极的铅失去电子,也变成硫酸铅 。
当铅和二氧化铅固体都变成硫酸铅后,电池没电了 。如果这个时候我们将两边的硫酸铅分别与外加电源相连,在电流的作用下,连接电源正极的硫酸铅失去电子变成二氧化铅,而连接电源负极的硫酸铅得到电子变成铅 。也就是说,电池的电量又重新被充满了 。