一.决定物质体积的微观因素
(1.)微粒多少:为了研究具有普遍性,选择1mol微粒作为研究标准
(2.)微粒大小:固体液体难于被压缩,忽略微粒间隔 。微粒种类不同体积不同
结论:1》.固体液体的体积主要微粒大小决定
2》.1mol固体液体不具有相同的体积,不研究其摩尔体积
(3.)微粒间隔:气体微粒间隔远大于微粒大小,把微粒看成质点 。气体的体积主要由微粒间隔决定 。温度,压强可以调整微粒间隔,从而间接决定体积
二.阿伏伽德罗定律及其推论:
(1)阿伏伽德罗定律:
在相同温度和压强下,相同体积的任何气体含都含有相同数目的分子 。
(2)阿伏加德罗定律推论:(不要死背结论,记住理想气体状态方程,根据题干条件推导)
根据理想气体状态方程PV=nRT及n=m/M、p(密度)=m/V可得出下列推论:
1、同温同压下,气体的分子数与其体积成正比:T、P相同n1:n2=V1:V2
2、温度、体积相同的气体,压强与其分子数成正比:T、V相同P1:P2=n1:n2
3、分子数相等,压强相同的气体,体积与其温度成正比:n、P相同V1:V2=T1:T2
4、分子数相等,温度相同的气体,压强与其体积成反比:n、T相同P1:P2=V2:V1
三.气体的摩尔体积:
(1)单位物质的量的气体所占有的体积,也就是1mol气体所占有的体积,单位L/mol,符号为Vm 。可以有以下公式:
n=V/Vm ρ=M/Vm
重点考察适用条件:1》物质处于标况下 2》处于标况下时是气体
(2)温度压强影响气体的体积,选取特定的状态研究气体的摩尔体积可以得出一个常量 。
(3)标准状况简称为标况(0℃,101kPa),1mol任何气体的体积都约为22.4L 。包括混合气体在内 。

文章插图
四.混合气体:
(1)平均相对分子量:
- 公式1法:M=m/n , m混合气体的总质量,n混合气体总的物质的量 。
- 公式2法:M=dVm. d是混合气体的密度,Vm是气体摩尔体积 。
- 相对密度法:M=DM1, D是相对密度,M1是相对气体的摩尔质量 。
- 理想气体公式法:PM=dRT,即M=dRT/P
- 平均式量法:M=M1w1+M1w2, M1.M2指混合气体的两种气体的摩尔质量,w1,w2指两种气体的物质的量百分数,或体积百分数,或分子个数百分数 。(2)十字交叉法:用来解决混合气体的成分是以何种体积比混合的
例题:由CH4和O2组成的混合气体在标况下的密度为1g/L,则该混合气体中CH4和O2的体积比为?
解析:气体密度ρ=m/V=M/Vm,所以混合气体在标况下的密度为1g/L,即混合气的平均摩尔质量为1g/L×22.4L/mol=22.4g/mol 。
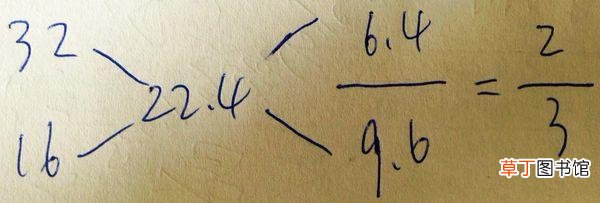
文章插图
【摩尔气体常数 阿伏伽德罗定律及其推论】1》选取的各数值属于同一个物理量 2》大减小,上比下
推荐阅读
- 光栅常数d怎么算
- 灭火器里面的气体多久能放完
- 氢气是一种什么样的气体
- 泊松比与什么有关
- 摩尔庄园怎么拍照 摩尔庄园怎么拍照任务
- 哪种气体密度比空气大
- 煤油燃烧后产生什么气体
- 空调外机排出的气体有毒吗
- 煤气罐里装的是什么气体
- 气体溶解度与什么有关